6 Réz anyagcserezavarok - Észak-Rajna Orvosi Egyesület
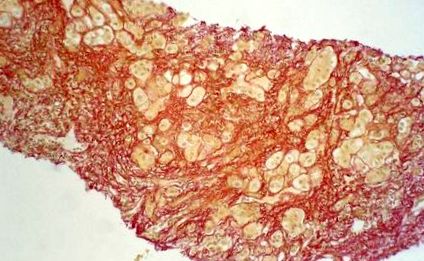
1. ábra: kicsi noduláris májcirrhosis
2. ábra: Pigmentlerakódások a Rodamin-foltban.
Forrás: Dr. professzor Hans-Peter Fischer, a bonni egyetemi kórház Patológiai Intézete
M. Wilson meghatározása
A Wilson-kór a réz anyagcseréjének ritka autoszomális recesszív betegsége. Az előfordulás 1: 30000. A tulajdonságok heterozigóta hordozóinak előfordulása 1:90 (1,2). A Wilson-betegség májformája gyakran 20 éves kora előtt nyilvánul meg; a betegség neurológiai stresszel járó formája 40 éves kor körül valószínű, 5 és 60 év közötti széles tartományban.
A betegséget a réz felhalmozódása vagy túlterhelése jellemzi, ami klinikai következményekkel jár, különösen a rézet felszívó szervekben, például a májban, a bazális ganglionokban, a szemekben, a vesékben és a vérben. Ezért a "hepatolenticularis degeneráció" kifejezés szintén ismert erre a betegségre (Asztal 1).
Ataxiával, szédüléssel és ingatag járással járó neurológiai szindrómát írt le először S. Wilson 1912-ben (3).
| Májjellemzők: | A transzamináz szint növekedése Hepatis steatosis, májfibrózis Hepato-/splenomegalia Akut hepatitis Májzsugorodás Akut májelégtelenség |
| Neurológiai jelek: | Mozgászavar remegés Dysarthria merevség Ataxia Migrén támadások szédülés Rohamok Diszkinézia |
| Pszichiátriai tünetek: | depresszió Neurózisok (pl. Szorongásos rendellenességek) A személyiség megváltozik Affektív rendellenességek Pszichózisok |
| Vérkép változásai: | Mikrocita vérszegénység Hemolitikus anémia Leuko-/thrombocytopenia |
| Szemváltozások: | Kayser Fleischer gyűrű Napraforgó szürkehályog |
Patogenezis/M. Wilson élettana
A réz nélkülözhetetlen nyomelem. Számos fontos réztartalmú enzimreakció zajlik le a szervezetben. A napi rézkészlet az élelmiszerekben körülbelül 1-3 mg, ami lényegesen magasabb, mint a napi szükséglet.
A réz szinte teljesen felszívódik a hepatocitákban. Ott a ceruloplazminhoz kötődik a további szállításhoz a testben. A felesleges, szabad és erősen sejtmérgező réz kiválasztódik az epében (2).
A Wilson-kór genetikai hibája a 13. kromoszóma hosszú karján található. Ez a gén egy ATP-függő réztranszportfehérjét, az úgynevezett ATP7B-t vagy Wilson-kór fehérjét kódol, amely a Golgi-készülékben található, különösen a hepatocitákban. A leggyakoribb mutáció Európában a H1069Q mutáció a 14. exonban (4).
Ennek a fehérjének az a feladata, hogy egyrészt biztosítsa a réz transzportját a Golgi rendszerbe a még mindig rézmentes apokoeruloplazminba való beépülés céljából, másrészt pedig lehetővé teszi a felesleges, szabad, mérgező réz epével történő kiválasztását.
A Wilson fehérje tehát kettős funkcióval rendelkezik: ellátja a szervezetet rézzel terhelt ceruloplazminnal, és ugyanakkor szabályozza a felesleges réz kiválasztódását.
Ha a májsejtekben a réz mennyisége alacsony, a rézzel terhelt ceruloplazmint (holocoeruloplasmin) vezikulákon keresztül távolítják el a májból. Magas rézkoncentráció esetén a réz az epehólyagok kiválasztásához a Wilson protein ATP7B-hez szállul, amely szintén az epehólyag aculi mikrotubulusain helyezkedik el.
M. Wilson klinikája
A klinikai megnyilvánulás különféle formáinak oka a réz túlterhelése a különböző szövetekben. Gyakran előfordulnak máj- és neurológiai megnyilvánulások, de a szem és a vérkép változásai is.
A máj megnyilvánulásában különbséget tesznek az akut és a krónikus forma között.
Az akut májelégtelenség leginkább fiatal, jó egészségi állapotú betegeket érint. A tanfolyam gyakran végzetes, kivéve, ha a beteget átültetik.
Az akut májelégtelenség gyakran társul hemolitikus, Coombs-negatív, normocita vérszegénységhez. A szabad, mérgező réz, amely főleg a hepatociták felbomlásakor szabadul fel, hemolízissel megbontja az eritrociták nátrium-kálium ATPázát. A hemolitikus anaemia tehát a Wilson-kór súlyos, akut lefolyásának, az úgynevezett Wilson-krízisnek a jele (5).
Krónikus formában a vérkép változása is megfigyelhető: a rézzel terhelt és így funkcionális ceruloplazmin meghatározó szerepet játszik a ferroxidáz és a vas anyagcseréjének enzimatikus reakciójában. Ha a ceruloplazmin működésképtelen a ferroxidáz kofaktoraként, ezt M. Wilsonnál megzavarhatják, így mikrocitás vérszegénység alakulhat ki a vashiányos vérszegénység értelmében.
A krónikus máj lefolyása kísérheti a transzaminázok növekedését, a sárgaságot és az általános állapot romlását. Ha a terápiát nem kezdik meg, akkor a májcirrózis portális hipertónia jeleivel alakulhat ki.
A neurológiai megnyilvánulások túlnyomórészt extrapiramidális jellegűek, a bazális ganglionok réz túlterhelése miatt. Olyan tünetek figyelhetők meg, mint ataxia, remegés, diszkinézia, dysarthria, de nyelvi nehézségek és mikrográfiák is.
Megfelelő terápia nélkül a neurológiai tünetek az intelligencia jelentős csökkenésévé és markáns mozgáskorlátozásokká válhatnak az ataxia, a görcsösség és a súlyos merevség miatt. Az epilepszia manapság lényegesen ritkább a megfelelő terápia mellett.
A képdiagnosztikában a változás különösen az Ncl területén tapasztalható. dentatus, a thalamusban, a belső kapszulában és a szürkeállományban.
A pszichiátriai tünetek elsősorban személyiségváltozások, például hangulatváltozások (pl. Dührohamok, ingerlékenység) és gyenge koncentráció. Depressziós epizódok és pszichózisok is előfordulhatnak.
A felfedezőkről 1902/2003-ban elnevezett Kayser-Fleischer gyűrűt gyakran figyelemfelkeltőnek tekintik. Ez egy barna-vöröses gyűrű alakú rézlerakódás a szaruhártya Descemet-membránjában. Ez a hasított lámpával végzett szemészeti vizsgálat során diagnosztizálható, és M. Wilson számára patognomikusnak tekinthető. A Kayser-Fleischer gyűrű azonban nem fordul elő minden Wilson-betegségben. Így a szaruhártya-gyűrű jelentősen alacsonyabb gyakorisággal rendelkezik, amely a májban megnyilvánul, szemben a neurológiailag vezető tünetekkel; itt szinte mindig van egy gyűrű, amelyet diagnosztizálni lehet.
A Kayser-Fleischer-gyűrűnek alig van betegségértéke. Legfeljebb enyhe látásromlás lehet. Ez azonban hasznos lehet a diagnózis felállításában. A bizonyított Kayser-Fleischer-gyűrű nem patognomikus a Wilson-betegségben, ezért más kolesztatikus májbetegségekben is előfordulhat, például primer biliaris cirrhosisban.
A szem további érintettsége a szürkehályog kialakulása a lencse réz lerakódása miatt (ezért a betegség másik neve: hepatolenticularis degeneráció). A szürkehályog napraforgószerű alakját mutatja.
M. Wilson diagnózisa
A májcirrhosis klinikai tünetei, például szklerén terus, pók naevi, ascites vagy akut májelégtelenség esetén mindig figyelembe kell venni a Wilson-kórt, különösen, ha extrapiramidális tünetek egyidejűleg jelentkeznek.
További laboratóriumi eredmények megerősíthetik a feltételezett diagnózist.
A következő konstelláció jellemző:
- a szabad réz koncentrációjának növekedése a szérumban (> 50µg/dl)
- csökkent ceruloplazmin koncentráció a szérumban (100 µg/24 óra)
A ceruloplazmin normális és megnövekedett koncentrációja esetén azonban előfordulhat; egyrészt ösztrogén hatása alatt, például terhesség alatt, másrészt akut fázisreakcióként. A szérumban a ceruloplazmin meghatározásakor a betegek 5 százalékánál hamis negatív eredményeket kapunk. Csecsemőknél ez a paraméter nem használható diagnosztikai értékként, ha a ceruloplazmin fiziológiailag alacsonyabb.
A több mint 100 µg/24 órás réz vizelettel történő kiválasztása megerősíti a Wilson-kór diagnózisát.
Egy másik fontos diagnosztikai lépés a perkután májszúrás. A máj parenchymájában jelentősen megnövekedett rézkoncentráció, több mint 250 µg/g, M. Wilson bizonyítéka. Mikroszkóposan a májban lévő kis noduláris májcirrózis és rézlerakódások képe látható a rodaminfestés után (2. táblázat).
Mivel M. Wilson genetikailag öröklődő betegség, felmerül a kérdés, hogy genetikai tesztekkel lehet-e megerősíteni a diagnózist. A Wilson-gén több mint 200 funkcionálisan hatékony mutációjának genetikai vizsgálata azonban csak akkor hasznos, ha pozitív a család története.
M. Wilson diagnózisa
- Fizikai vizsgálat: májcirrózis vagy májelégtelenség jelei, neurológiai rendellenességek.
- Szemvizsgálat réslámpával: Kérdezzen a Kayser-Fleischer gyűrűről
- Laboratóriumi kémiai diagnosztika:
| Ceruloplasmin a szérumban | 50 ug/dl |
| Réz a vizeletben | > 100 ug/24 óra |
| A májcirrhosis szövettani jelei | |
| A máj réztartalma: | > 250 ug/g száraz tömeg |
M. Wilson terápiája
A terápiát mindig a diagnózis után kell elkezdeni, a betegség súlyosságától függetlenül, és véglegesen folytatni kell (3. táblázat).
A cél az, hogy eltávolítsa a felesleges rézt a réztároló szervekből.
Alacsony réztartalmú étrendet kell betartani. A terápia fő hangsúlya a gyógyszeres kezelés. Vezető májtünetek esetén a májtranszplantáció indikációját - a máj dekompenzáció mértékétől függően - az egyetlen fennmaradó kezelési lehetőségként értékelni kell.
A gyógyszeres terápiához olyan kelátképző szerek állnak rendelkezésre, mint a penicilliamin (metalkaptáz) vagy a trientin (trietilén-tetramin-dihidroklorid), amelyek kelát-komplexet alkotnak a rézzel és növelik annak kiválasztódását, vagy a cink, amely jelentősen csökkenti a réz felszívódását.
A penicillamint napi 1 g kezdő adagban kell beadni, egy vagy két adagra elosztva. A terápia akkor tekinthető sikeresnek, ha a normál rézkoncentráció a szérumban és a réz kiválasztása a vizelettel kevesebb, mint 500 µg/24 óra.
A penicillamin beadása azonban számos mellékhatással társulhat: kiütésekhez, lázhoz, lymphadenopathiákhoz vezethet, de nephrotikus szindróma vagy autoimmun jelenségek, például lupus erythematosus kialakulásához is vezethet (7).
Ezek a mellékhatások évekkel a kezelés megkezdése után is előfordulhatnak; így alkalmanként terápiás változtatásra van szükség. Ezután megváltoztathatja a kelátképző szert, és elkezdheti a Trientine-t, amelynek kevesebb mellékhatása van. De itt is meg kell figyelni olyan mellékhatásokat, mint a vashiányos vérszegénység és a kontakt dermatitis.
A trientin adagja napi 750 és 1250 mg között van, és napi 2-4 adagra kell osztani.
Egy másik terápiás lehetőség a cink beadása. A cink egyrészt úgy működik, hogy gátolja a réz felszívódását a bél nyálkahártya sejtjein a rézt abszorbeáló transzporterek versenyképes gátlásával, másrészt a rézet elnyelő fehérje metallotionein indukciójával indukálja a rézet a bél nyálkahártya sejtjeiben, és hatástalanná teszi.
Összefoglalva: az alacsony réztartalmú étrenddel kombinált gyógyszeres terápiát következetesen az egész életen át folytatni kell. A terápia sikere azonban a szérum szabad rézkoncentrációjának csökkenése és a tünetek szempontjából csak a kezelés megkezdése után hat hónappal várható.
Mint fent említettük, és az eseti jelentésben leírt fiatal beteg esetében a májtranszplantációt javallt vezető májbetegség esetén, akut májelégtelenség vagy dekompenzált májcirrózis jeleivel. Mivel a hepatocitákban az ATP7B expresszió elsősorban felelős a betegségért, a májtranszplantáció után általában nincs szükség további gyógyszeres terápiára (9). A jövőben a génterápiás megközelítések meghatározó szerepet játszhatnak M. Wilson terápiájában is.
Ha a máj- és/vagy neurológiai tünetek nem egyértelműek fiatalabb betegeknél, de 40 év körüli felnőtteknél vagy akár 60 év körüli esetekben is, a ritka raktározási betegségre kell gondolni. A diagnózis egyszerű laboratóriumi kémiai vizsgálatokkal és szükség esetén májszövettan segítségével igazolható. Az ezt követő, következetes, egész életen át tartó terápiát gyorsan el kell végezni, és döntő befolyással lehet a betegség lefolyására, minél előbb elkezdődik.
| Előkészítés/hatás | adagolás | Mellékhatások |
| D-penicillamin (Kelátképző szer, a rézkiválasztás fokozódik) | 900-2400 mg/24 óra | Túlérzékenységi reakciók, Nefrotoxikus hatás, Autoimmun jelenség |
| Trientine (Kelátképző szer, a réz kiválasztódása fokozódik) | 1200-2700 mg/24 óra | Vashiányos vérszegénység, gyomorhurut |
| Cink (szulfát, acetát, hisztidin) (A bél réz felszívódásának gátlása) | 45 mg/24 óra (cink) | Emésztőrendszeri panaszok, dyspepsia, A hasnyálmirigy enzimek növekedése |
Irodalom és linkek
1) Schilsky M.L. Wilson-kór: a réz-toxicitás genetikai alapjai és a természettörténet. Semin Liver Dis 1996; 16: 83-95.
2) Gitlin JD. Wilson-kór Gasztroenterológia 2003; 125: 1868-1877.
3) Wilson S. Progresszív lencsés degeneráció: a máj cirrhosisával járó családi idegi betegség. Agy 1912; 34: 295.
4) Riordian S., Williams R. A Wilson-kór génje és fenotípusos változatossága. J Hepatol 2001; 34: 165-171.
5) Stremmel W. Akut májelégtelenség diagnosztikai jellemzői fulmináns Wilson-kórban Z Gastroenterol 1992; 61, 317-328.
6) Walshe JM. Penicillamin, a Wilson-kór új orális terápiája. Am J Med 1956; 21: 487-495.
7) Walshe JM. A Wilson-kór kezelése trientinnel. Lancet 1982; 1: 643-647.
8) Oestreicher P., RJ unokatestvérek. A réz és a cink felszívódása patkányokban: A kölcsönös antagonizmus mechanizmusa J Nutr 1985; 115: 159-166.
9) Sternlieb I. Wilson-kór: javallatok májtranszplantációra. Hepatology 1984; 4: 15-17.
- 55 Ismeretlen eredetű többszörös osteolysis - North Rhine Medical Association
- 50-től akarat; kritikus A szem hét legnagyobb ellensége
- 03 Zsír és cukor Funkkolleg 2019-2020
- Asztigmatizmus (asztigmatizmus, asztigmatizmus)
- Mugwort allergia Mit kell tenni Hogyan kell