Bórsav - biológia
Molekuláris iránytű a sejtek igazításához
Mi teszi a levelek öregedését ősszel
A keselyű gyöngytyúk demokráciája
Ekembo környezete: Az emberek nyílt tájakon is éltek
| Genetika | Mezőgazdaság, erdészet és állattenyésztés
A búzafajtát vad füvek keresztezésével hozták létre
| Genetika | Mezőgazdaság, erdészet és állattenyésztés
Árpa Pangenom: Mérföldkő az üveggyár felé vezető úton
Csökkentett táplálékfogyasztással, hosszabb élettartammal
Az állatmentes módszer megjósolja a nanorészecskék toxicitását
Sejtvándorlás: egy ismert fehérje újonnan felfedezett funkciója
Bórsav
171 ° C (bomlik) [3]
szegény vízben (50 g · l −1 20 ° C-on) [1]
Bórsav (szintén: Ortobórsav), A H3BO3 a legegyszerűbb bór oxigénsav. Sóikat borátoknak nevezzük.
Előfordulás és kitermelés
A szabad bórsav a közép-olaszországi Toszkánában található vízgőzforrásokban (fumarolokban) található; a sav ezekből a forrásokból nyerhető fényes vérlemezkékben történő párologtatással. A bórsav megtalálható Toszkánában is, mint ásványi szassolin. Az alkáli- és alkáliföldfémsók, mint például a Na2B4O7 · 4 H2O ásványi kernit, azonban nagy jelentőséggel bírnak. Hasonló, ritkább ásványi anyag a bórax, amely 8 vagy 10 ekvivalens kristályvizet tartalmaz. Manapság azonban ezt elsősorban a kernitből nyerik. A bórax sósavval vagy kénsavval történő kezelésével bórsav szabadulhat fel.
jellemzők
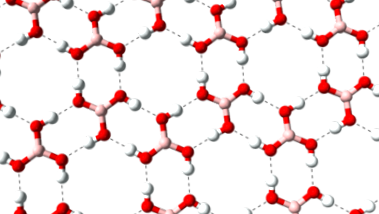
A tiszta bórsav pelyhes, színtelen, fényes kristályokat képez, amelyek olvadáspontja 171 ° C. Ezek olyan rétegszerkezetet alkotnak, amelyben hidrogénkötések keletkeznek az egyes bórsavmolekulák között. Két réteg közötti távolság 318 pikométer (pm).
Kezdetben nehéz feloldódni a vízben, de ez a folyamat a koncentráció növekedésével felgyorsul. Az oldat enyhén savas. Az ortobórsav felmelegítésekor a víz szétválik, és a HBO2 metabórsav, amely többféle módosítással fordul elő, végül diboron-trioxid (B2O3) képződik a víz további eltávolításával.
Három hidrogénatomja ellenére a bórsav monoprotonsavként reagál a vízben, és a tetrahidroxoborát-ion (B (OH) 4 - képződésével reagál. Nem úgy viselkedik, mint egy Brønsted-sav, mint proton donor, hanem mint egy Lewis-sav, mint egy hidroxid-akceptor:
A bórsav nagyon gyenge sav (pKa = 9,25). Többértékű alkoholokkal, például mannittel reagáltatva a sav erőssége jelentősen növelhető. Ez annak köszönhető, hogy az észterezés eredményeként az egyensúly jobbra tolódik egy tetraoxoborát-származék felé:
Ezt a reakciót alkalmazzák a bórsav alkalimetrikus titrálásához.
bizonyíték
A bórsav és sói, a borátok alkotják az illékony bórsav-metil-észtert metanollal és a dehidratáló tömény kénsavval, amely zöld lánggal ég és kvalitatív kimutatásra szolgál. [5]
használat
Az orvostudományban a bórsavat használták vizes oldatként (Bórvíz) és kenőcs (Bór kenőcs) enyhe fertőtlenítőszerként használják [6]. A bórsavat tartalmazó gyógyszerek 1984-es, a Szövetségi Egészségügyi Hivatal általi akkori visszahívása óta a bórsavat, valamint észtereit és sóit csak pufferoló és izotóniás hatású szemcseppekre, valamint homeopátiás hígításokban történő felhasználásra engedélyezték [7]. Az élelmiszeriparban a bórsavat tartósítószerként használják, E 284 jelöléssel. A bórsav közbenső termék a boroszilikát üveg, porcelán, zománc gyártásában, és égésgátlókban és foltokban is alkalmazzák. A bórsav éves világtermelése meghaladja a 200 000 tonnát.
Egy másik alkalmazás az oldott bórsav alkalmazása nyomottvizes atomreaktorokban neutronelnyelő anyagként a láncreakció szabályozására. A természetes bórban termikus neutronok 20% -os 10 B izotópjának nagy abszorpciós keresztmetszetén alapul. Itt zajlik a nukleáris reakció
A bórsavat a széndioxid-tartalom geológiai idõkben történõ kiszámítására is használják. Savas környezetben a bórsav egyre inkább beépül a 11 bórba. Amikor a pH-érték lúgosra változik, a bórsav boráttá, bórsav sóvá alakul. Mivel a foraminiferáknak (a fosszilisnak, valamint a legújabb egysejtű szervezeteknek) borátra van szükségük héjuk felépítéséhez, az arány alapján meghatározható, hogy a földtörténet melyik pontján melyik pH-érték volt jelen ezen a területen. Mivel az ilyen protozoonok és kagylók stb. Héjai alkotják a tengeri üledék fő részét, az üledékmagok egyszerűen eltávolíthatók onnan, és a laboratóriumban megvizsgálhatják a két bórizotópot. Az ilyen eredmények jól korrelálnak a jégmagokban rekedt légbuborékokkal.
A metil-borát elégetésekor zöld láng keletkezik, míg más alkoholok bórsav-észterei égéskor zöld lángvonalat mutatnak. Ezt a tulajdonságot használják a metanol azonosítására (iskolai kísérlet) [8] és a pirotechnikában például a tűzrudak, a poi vagy a tűztálak lángjának színezésére.
3% -os bórsavoldat (bórvíz) alkalmazható lúgok okozta kémiai égések esetén. Maga nem maró hatású, és semlegesítheti a lúgokat.
A játékként értékesített iszapban legfeljebb 1,3% bórsavat detektáltak („Slimys”). [9] A nyálkás tömeg viszkozitása a bórsavtartalommal növekszik. A gyártás során fontos biztosítani, hogy a tartalom állandóan alacsony legyen, mivel káros egészségügyi hatásokra akkor is számítani kell, ha csak 50 mg/testtömeg-kg fogyasztunk. [10]
Veszélyes anyagok listája
2010 júniusában az ECHA a bórsavat felvette az SVHC (nagyon aggasztó anyag) jelöltlistájára. Az 1272/2008/EK GHS rendelet és a 790/2009/EK REACH módosító rendelet hatálybalépését követően a bórsavat reprodukciót károsító anyagként jelölték meg. Azokat a keverékeket, amelyek szabad bórsavat tartalmaznak legalább 5,5% koncentrációban, reprodukciót károsító anyagként is fel kell tüntetni a GHS-rendelet szerint.
- Coregonus - biológia
- Borealis pajzs - biológia
- Padua Botanikus Kert - Biológia
- Aquazoo - Löbbecke Múzeum - Biológia
- Adenium obesum - biológia