3D emberi extracelluláris mátrix adipocita tenyésztési modell a mátrix-sejt metabolikus áthallás vizsgálatához
Összegzés
Leírunk egy 3D emberi-ember extracellum mátrix-adipocita in vitro tenyésztési rendszert, amely lehetővé teszi a mátrix és az adipociták szerepének lebontását a zsírszövet metabolikus fenotípusának kodipálásában.
Absztrakt
Bevezetés
Az extracelluláris mátrix (ECM) nemcsak mechanikus keretet biztosít a szövet számára, hanem a benne lakó sejtekkel folytatott komplex beszélgetés során is beavatkozik, és szabályozza a szövetek homeosztázisához szükséges különféle folyamatokat, beleértve a sejtek szaporodását, differenciálódását, Jelzés és anyagcsere 1. Míg az egészséges ECM alapvető szerepet játszik a szövetek normális működésének fenntartásában, a diszfunkcionális ECM számos betegségben érintett 2 .
A zsírszövet fontos szerepet játszik az anyagcsere-betegségek patogenezisében. Az elhízás túlzott adipocita hipertrófiával és celluláris hipoxiával, az adipocita sejtek anyagcseréjének és zsírszövetének hibáival, több endoplazmatikus retikulummal, oxidatív stresszel és gyulladással jár. Bár ezek a bonyolult folyamatok kevéssé ismertek, a zsírszövet pufferképességének kompromittálására törekszenek, ami a zsírszövetből származó tápanyagok túlcsordulását, több szöveti toxicitást és szisztémás anyagcsere-betegséget eredményez. A zsírszövet meghibásodásának hátterében álló események sorrendje és specifikus mechanizmusai kevéssé ismertek, de a zsírszövet ECM változásai szerepet játszottak. Az ECM összetétele megváltozik a zsírszövetben az emberi és az egér elhízásakor, az ECM fehérje fokozott lerakódása mellett a zsírszövet ECM minőségi biokémiai és strukturális különbségei is társulnak az emberi anyagcsere-betegségekhez, beleértve a 2-es típusú cukorbetegséget és a hiperlipidémiát 6, 7, 8, 9, 10, 11 .
E megfigyelések ellenére a zsírszövet ECM szerepe a zsírszövet diszfunkciójának közvetítésében nincs pontosan meghatározva. Ennek oka részben az olyan robusztus kísérleti modellek hiánya, amelyek lehetővé teszik az ECM és az adipociták specifikus szerepeinek lebontását a végső zsírfunkció szabályozásában. Az ECM adipocita tenyészet legalább két ponton szimulálja a natív zsírszövet in vivo környezetét. Először is, az ECM kultúra olyan molekuláris környezetet biztosít, amely hasonló a natív zsírszövethez, beleértve a natív kollagéneket, elasztinokat és más mátrixfehérjéket, amelyek hiányoznak a standard 2D kultúrából. Másodszor, bebizonyosodott, hogy a 2D műanyag tenyészete a 12 műanyag szubsztrát csökkent rugalmassága miatt mechanikai hatások révén megváltoztatja az adipocita anyagcserét, ami kiküszöböli az ECM kultúrát.
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Jegyzőkönyv
Az elhízott szöveteket olyan emberi alanyoktól szerzik be, akiket választható bariatrikus műtéten végeznek az intézményi felülvizsgálati bizottság jóváhagyásával.
1. Preadipocita izolálás és tenyésztő reagens előállítás
- Készítsen 2% szarvasmarha-szérum albumint (BSA) 1x foszfáttal pufferolt sóoldatban (PBS). Sterilizálja a szűrőt és 4 ° C-on tárolja.
- Készítse elő a II-es típusú kollagén orrát: 2 mg/ml 2% BSA-ban 1x PBS-ben. Használat előtt közvetlenül készítse elő.
- Készítsük el a vörösvértest (RBC) lizáló oldatot: 1,5 M NH4Cl, 100 mM NaHCO3, 10 mM dinátrium-EDTA ionmentes vízben (DI/H2O). 4 ° C-on tárolandó. Készítsen 1x RBC lizáló oldatot 10x DI/H2O tárolóoldatból közvetlenül használat előtt.
- Készítsen növekedési táptalajt: 15% szarvasmarha-magzati szérum (FBS), 1% gombaellenes oldat (ABAM) Dulbecco módosított Eagle táptalajában: F-12 tápanyag-keverék (DMEM/F12). Sterilizáljuk a szűrőt és 4 ° C-on tároljuk.
- Készítsünk preadipocita fagyasztó oldatot: 10% dimetil-szulfoxid, 15% FBS DMEM/F12 táptalajban. Sterilizálja a szűrőt és 4 ° C-on tárolja.
- Differenciáló közegek előállítása: 10 mg/l transzferrin, 33 'M biotin, 0,5' M humán inzulin oldat, 17 'M D-pantoténsav-hemikalcium-só, 100 nM dexametazon, 2 nM 3,3', 5-trijido-L-tironin-nátriumsó (T3), 1 izobutil-1-metilxantin (IBMX), 1% ABAM DMEM/F12-ben. Sterilizáljuk a szűrőt és 4 ° C-on tároljuk.
3. Metabolikus fenotipizáló reagenskészítés
- Glükózfelvétel
- Készítse elő a szérum éhező táptalajt: DMEM/F12, 1% ABAM. Sterilizálja a szűrőt és 4 ° C-on tárolja
- Készítsen 200 nM humán inzulin oldatot 1x PBS-ben közvetlenül használat előtt.
- Készítsen 200 nM humán inzulint, 0,1 mM 2-dezoxi-D-glükózt, 1 Ci/üreg dezoxi-D-glükóz, 2- [1,2-3H (N)] - 1x PBS-ben. Használat előtt közvetlenül készítse elő.
- Lipolízis
- Készítsünk izoproterenolt PBS-ben hígítva: 3 mM törzsoldat. A vizsgálathoz 3 m-es koncentrációt hígítsunk.
- Olajvörös-O színezés
- Készítsen 4% formalint DI/H2O-ban. Szobahőmérsékleten.
- Készítsen Oil Red-O működő oldatot. Hígítsa az Olaj Red-O oldatot (ORO) DI/H2O-val 3: 2 arányban (ORO: DI/H2O). Használat előtt közvetlenül készítse elő. Szűrje át szűrőpapíron (Anyagtábla).
4. A zsírszövet beszerzése
MEGJEGYZÉS: A műtét kezdetén a sebész eltávolítja a zsigeri zsírszövetet (VAT) a nagyobb omentumból, és azonnali feldolgozás céljából jégen visszaszállítja a laboratóriumba. Univerzális óvintézkedéseket kell betartani az emberi szövetek és maró reagensek kezelésénél, ideértve az összes munkát lamináris átáramló motorháztetőben, teljes laboratóriumi biztonsági kopás és tűk visszaesése nélkül.
- Adjunk hozzá 5-10 g ép áfát 15-25 ml fagyasztó pufferoldathoz 50 ml-es kúpos csőben a szövetminta merítéséhez. A mintákat decellularizációig -80 ° C-on tároljuk legfeljebb 1 hónapig.
- Használjon külön friss kádmintát az előreadipocita izolálásához az 5. szakaszban leírtak szerint.
6. A zsírszövet ECM előkészítése
8. Metabolikus fenotipizálás
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Reprezentatív eredmények
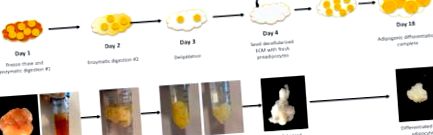
1. ábra: Munkafolyamat az ECM adipocita előállításához. 1. nap: A teljes zsigeri zsírszövetminták három fagyasztás-felolvasztási cikluson mennek keresztül, majd egy éjszakán át inkubálják az enzimatikus emésztőoldattal # 1. 2. nap: Az 1. számú enzimatikus oldattal történő emésztést követően a mintákat egy éjszakán át a 2. számú enzimatikus emésztési oldattal emésztjük. Ezen a ponton a mintákat részben lebontják. 3. nap: 2. számú enzimatikus emésztés után a mintákat egy éjszakán át inkubáljuk egy poláros oldószeres extrakciós oldattal, amely befejezi a delipidálást. A 3. nap után a mintáknak teljesen le kell lepattintaniuk és fehér/áttetsző színűeknek kell lenniük. A mintákat alaposan öblítő pufferoldattal, majd 70% -os etanollal mossuk, és 40 ° C-on tárolóoldatban tároljuk, amíg presipocitákkal feltölthetők. 4. nap: A preadipocytákat decellularizált áfába oltjuk 14 napig, majd adipogén differenciálást alkalmazunk. A kép nagyobb verziójának megtekintéséhez kattintson ide.

2. ábra: Prereadipocita izolációs munkafolyamat. A forgalmi adót felaprítjuk, kollagenázzal emésztjük, szűrjük, centrifugáljuk, és az így kapott sztromovaszkuláris sejtpelletet aranyozzuk és tenyésztjük az presipociták bővítéséhez. Az emberi presipocita izolációról és a 2D adipocita tenyésztésről további információkat Baker és mtsai. 2017 21. A kép nagyobb verziójának megtekintéséhez kattintson ide.

3. ábra: Pásztázó elektronmikroszkópos képek. Intakt zsírszövet, decellularizált zsírszövet és decellularizált zsírszövet, amelyeket 14 napig prepocitákkal újratelepítettek és adipogén közegben differenciáltak. A kép nagyobb verziójának megtekintéséhez kattintson ide.
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Vita
Hasonló módszereket publikáltak az ECM zsírszövetből történő izolálására és presipocitákkal történő beoltására, és bizonyítékok arra utalnak, hogy az ECM klasszikus adipogén mediátorok, köztük cAMP agonisták nélkül is elősegítheti az adipogén differenciálódást. Inzulin és PPAR agonisták 12, 14. Adataink elsőként mutatják be a sejtek metabolizmusának betegségspecifikus szabályozását az ECM által a zsírszövetben, olyan módszerek alkalmazásával, amelyekben az adipocitákat klasszikus adipogén differenciálódási faktorokkal stimulálják 11; hasonló vizsgálatok adipogén ingerek nélkül a jövőbeni kutatások célja. Mások hasonló betegségspecifikus ECM-sejtek túlcsordulnak az ECM-mel és a tüdőszövet sejtjeivel 19, 20. Alternatív stratégiákat is alkalmaztak, beleértve a mátrixok létrehozását homogenizált zsírszövet ECM-készítmények peptid-hidrogélekben történő keverésével 12 .
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Közzétételek
A szerzők nem nyilatkoznak ellentmondó érdekekről.
- Emberi ex vivo ateroszklerotikus plakkmodell a sérülésbiológiai protokoll tanulmányozásához (németre fordítva)
- Ez a csinos modell a lánya •
- Ez a modell sugarakkal úszik - és üzenete van •
- Ez a modell napi 3 almát evett 8 hónapig
- Az emberi aorta perivaszkuláris zsírsejt progenitor sejtjeinek differenciálódási kapacitása (fordítva